
近年來,還原偶聯(lián)反應成為構建有機分子的有效策略。這類反應中涉及兩種不同的親電試劑參與反應,并且大部分反應被認為NiI物種為反應的催化活性物種(Figure 1A)。2019年,胡喜樂課題組報道了鎳催化烷基鹵化物與氯甲酸酯的還原偶聯(lián)反應,該反應涉及Ni0物種與氯甲酸酯發(fā)生氧化加成形成NiII物種(Figure 1B)。基于前人的工作,最近,阿卜杜拉國王科技大學(KAUST)Chen Zhu和Magnus Rueping課題組實現(xiàn)了具有挑戰(zhàn)性的鎳催化芳基鹵化物、烷基鹵化物和氯甲酸乙酯的三組分還原偶聯(lián)反應。此反應利用氯甲酸乙酯作為簡單易得的CO源,實現(xiàn)了多種芳基烷基酮的合成。相關成果發(fā)表在Angew. Chem. Int. Ed., 2022, DOI: 10.1002/anie.202204144上(Figure 1C)。
 (圖片來源:Angew. Chem. Int. Ed.)
(圖片來源:Angew. Chem. Int. Ed.)
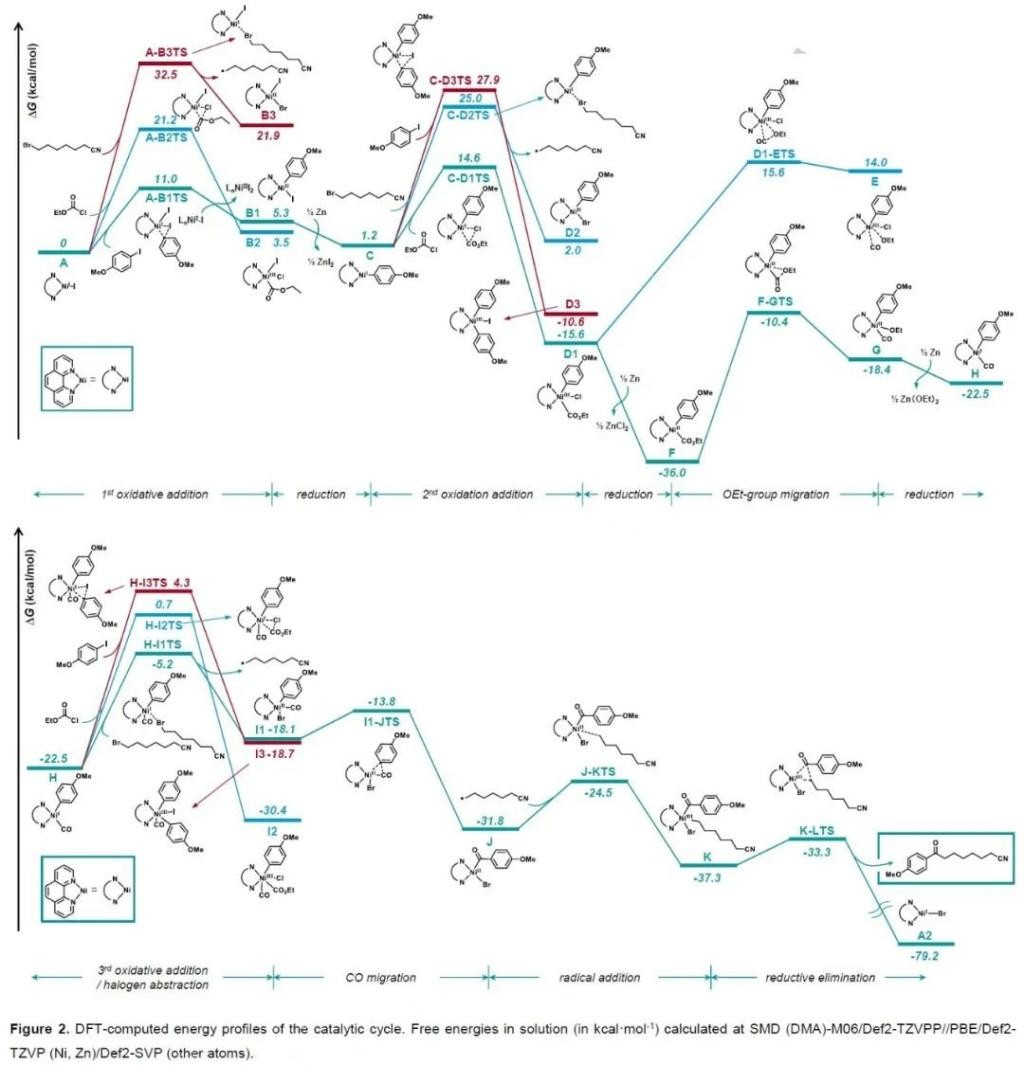
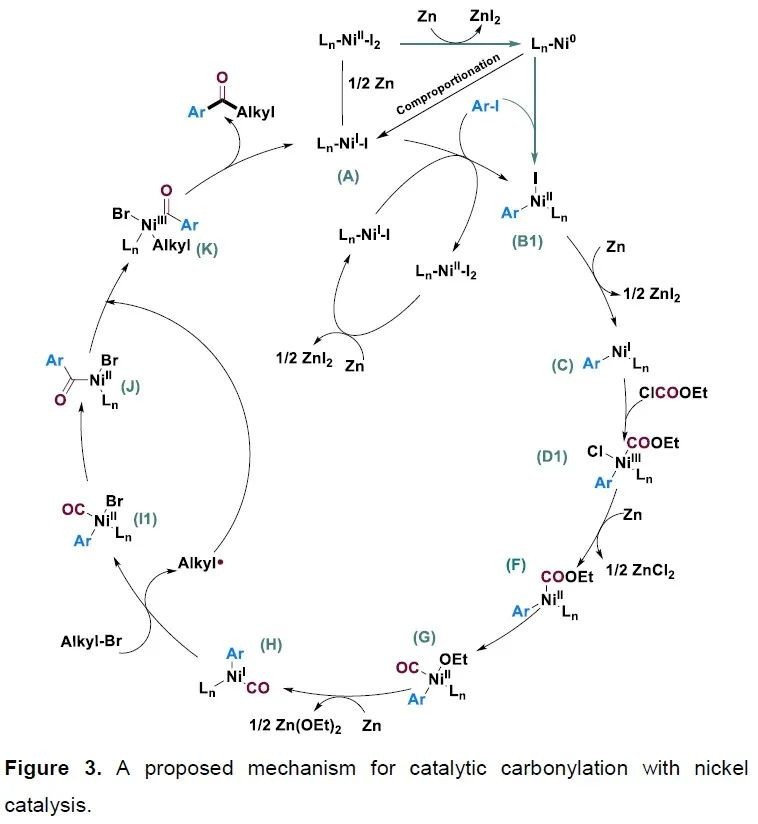
由于此轉化包含三種不同的親電試劑參與反應,因此高化學選擇性地識別各組分的反應活性具有一定的挑戰(zhàn)。為了更深入理解此反應的活化模式和反應細節(jié),作者首先進行了DFT計算(Figure 2)。基于計算結果,作者提出了此反應可能的催化循環(huán):首先NiII被Zn還原成Ni0;隨后Ni0與NiII發(fā)生歸中得到NiI中間體A;接著A與芳基鹵化物發(fā)生氧化加成,并與另一個NiI中間體A發(fā)生歸中得到Ar-NiII-I中間體B1;此外,芳基碘化物還可以和Ni0直接發(fā)生氧化加成得到中間體B1;接著B1可以被Zn還原為Ar-NiI中間體C;C可以與氯甲酸乙酯發(fā)生氧化加成得到NiIII中間體D1,然后被Zn還原為NiII中間體F;隨著OEt基團發(fā)生遷移,得到新的NiII中間體G,并進一步被Zn還原為Ar-NiI-CO中間體H;接著中間體H與烷基溴化物發(fā)生反應得到烷基自由基和中間體I1;I1發(fā)生CO遷移得到關鍵的酰基鎳中間體J;接著J被烷基自由基捕獲得到烷基-NiIII-酰基中間體K,而后K經歷還原消除得到產物并再生NiI物種(Figure 3)。
(圖片來源:Angew. Chem. Int. Ed.)
 (圖片來源:Angew. Chem. Int. Ed.)
(圖片來源:Angew. Chem. Int. Ed.)
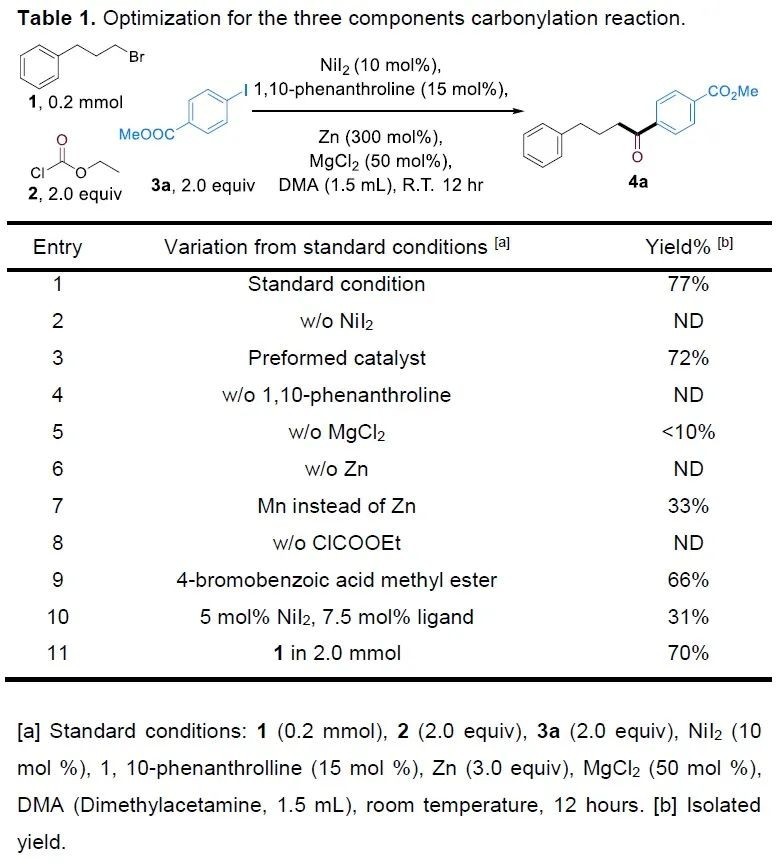
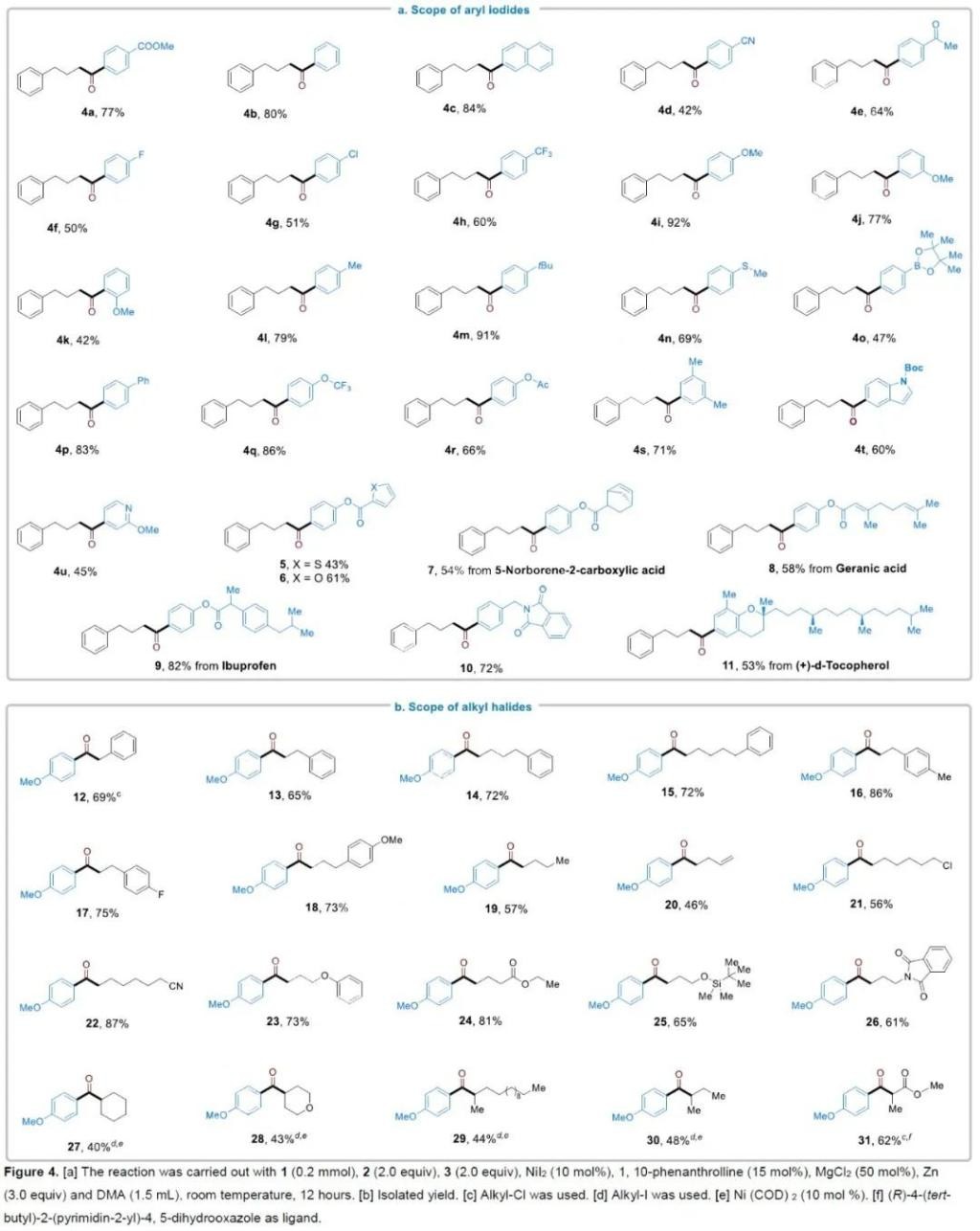
在推測了可能的反應機理后,作者以1-溴-3-苯基丙烷1、氯甲酸乙酯2和4-碘苯甲酸甲酯3a作為模板底物進行條件篩選(Table 1)。當反應使用NiI2作為催化劑,1,10-鄰菲啰啉作為配體, Zn作為還原劑,MgCl2作為添加劑,DMA為溶劑,室溫下反應12 h,可以以77%的產率得到相應的產物4a(Table 1,entry 1)。
 (圖片來源:Angew. Chem. Int. Ed.)
(圖片來源:Angew. Chem. Int. Ed.)
(圖片來源:Angew. Chem. Int. Ed.)
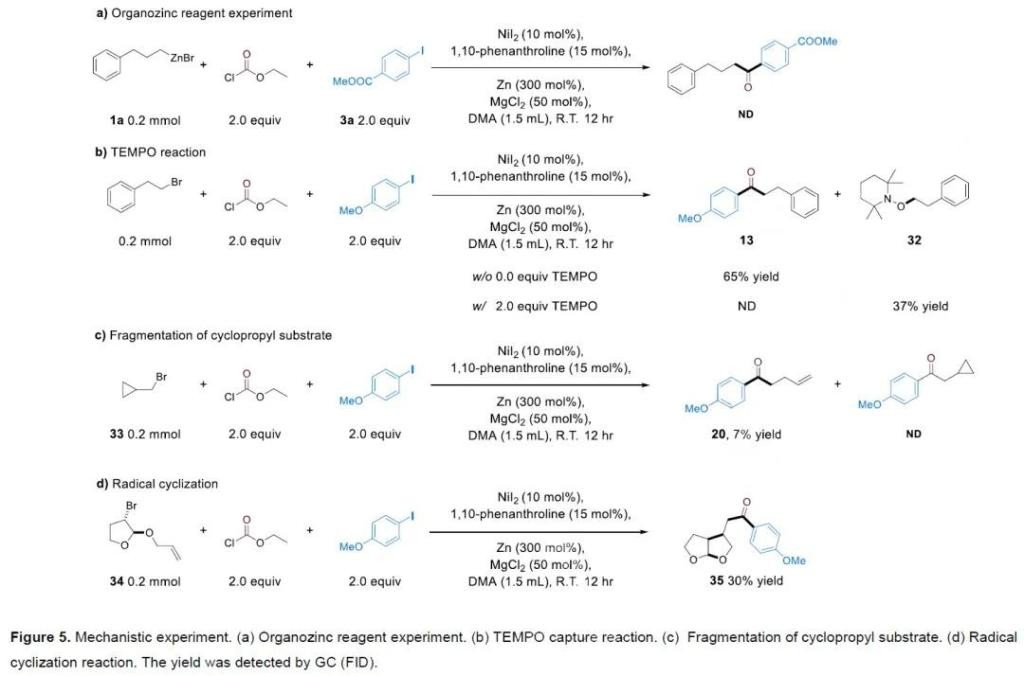
最后,為了進一步探索反應機理,作者進行了一系列控制實驗(Figure 5)。當反應中利用有機鋅試劑替代烷基鹵化物反應時并沒有得到相應的產物,說明產物酮的形成過程并沒有涉及有機鋅試劑的形成(Figure 5a)。當反應中加入自由基捕獲劑TEMPO時,反應被完全抑制,并以37%的產率觀察到了自由基捕獲產物32(Figure 5b)。當使用溴乙基環(huán)丙烷33參與反應時也沒有得到相應的產物酮,而是得到了開環(huán)產物20(Figure 5c)。當使用串聯(lián)烯烴的烷基溴化物作為底物時,可以以30%的產率得到相應的環(huán)化偶聯(lián)產物35(Figure 5d)。上述實驗均可以證明反應中包含烷基自由基中間體。
(圖片來源:Angew. Chem. Int. Ed.)
總結:阿卜杜拉國王科技大學(KAUST)Chen Zhu和Magnus Rueping課題組利用鎳催化的還原羰基化策略,使用芳基鹵化物、烷基鹵化物和氯甲酸乙酯作為起始原料,實現(xiàn)多種芳基烷基酮的合成。氯甲酸乙酯可以作為簡單易得的CO源應用到反應中。此反應顯示出較好的官能團耐受性和底物兼容性。DFT計算和控制實驗為反應機理的提出提供了理論依據(jù)。文獻:https://onlinelibrary.wiley.com/doi/10.1002/anie.202204144